武汉大学舒红兵院士在CMI发文,显示β-肾上腺素受体激活PKA按捺抗病毒固有免疫应答机造
先天免疫反响是宿主抵御病毒传染的之一道防线。微生物的构造守旧成分称为病原体相关分子形式(PAMPs),由宿主形式识别受体(PRRs)识别,从而诱导I型骚乱素(IFN)、促炎细胞因子和其他下流效应基因的表达。病原体的RNA和DNA是重要的DAMPs分子,哺乳动物细胞中常见的RNA感触感染器包罗RIG-I和MDA5,它们识别病毒RNA后会被招募至线粒体,与VISA(又称MAVS)连系并向下流传递信号。
在哺乳动物细胞中,最普遍表达和激活的胞浆病毒DNA传感器是cGAS。DNA与cGAS的连系触发活性部位的构象改变并合成cGAMP,cGAMP进而连系并激活MITA(也称为STING)并引发抗病毒免疫应答。压力和焦虑增加了人类传染病毒的懦弱性,然而那种易感性背后的机造仍然知之甚少。已有的研究表白,急性压力或焦虑会激活下丘脑-垂体-肾上腺皮量轴和交感神经系统,招致应激激素的产生,包罗糖皮量激素、肾上腺素和往甲肾上腺素。那些压力激素会影响免疫系统的功用,进而招致疾病的易感。但是目前还不清晰那些压力激素能否调剂机体的抗病毒固有免疫应答。

近期,由武汉大学 舒红兵院士领衔的研究团队在本刊颁发标题问题为“ β-adrenoreceptor-triggered PKA activation negatively regulates the innate antiviral response”的研究功效。他们发现病毒传染降低小鼠应激激素肾上腺素和往甲肾上腺素及其受体ADRB1/2的表达程度。此外,肾上腺素/往甲肾上腺素—ADRB1/2信号能够激活PKA,进而磷酸化MITA和VISA按捺其活性,按捺抗病毒固有免疫应答。
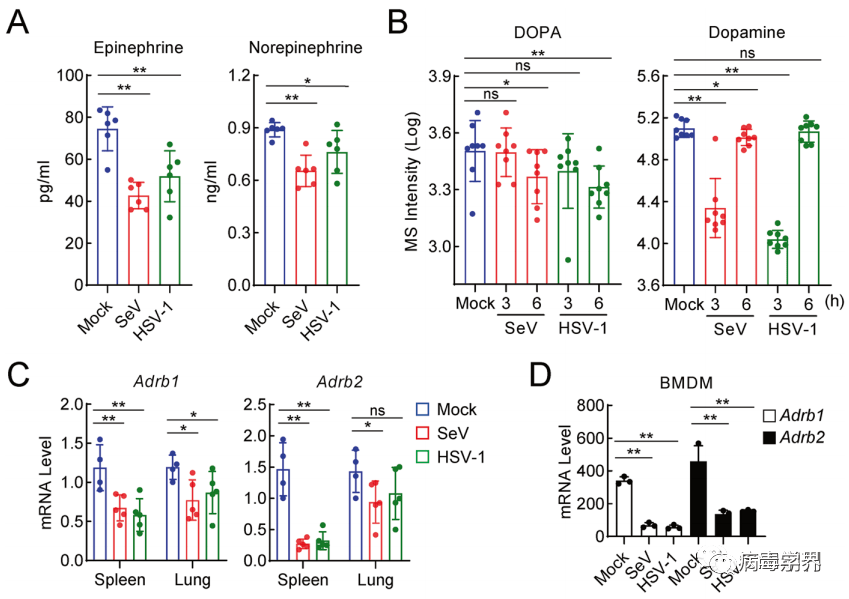
此前已有研究表白,压力和焦虑会增加人类对病毒传染的易感性,研究团队想晓得肾上腺素(EPI)和往甲肾上腺素(NE)能否会对宿主的抗病毒免疫产生影响。因而,研究团队检测了病毒传染前后小鼠的血清肾上腺素和往甲肾上腺素程度。成果表白,用RNA病毒SeV或DNA病毒HSV-1传染小鼠6h后,小鼠血清EPI和NE及其前体DOPA和多巴胺程度下降。此外,传染SeV或HSV-1的小鼠脾和肺中肾上腺素/往甲肾上腺素受体Adrb1和Adrb2的mRNA程度降低。利用BMDM以及THP-1停止尝试也得到了同样的结论。
展开全文
病毒传染下调肾上腺素/往甲肾上腺素及其受体
上面的研究成果表白病毒传染会影响EPI和NE的浓度,那么EPI和NE匹敌病毒免疫反响有着如何的影响呢?研究团队利用EPI、NE或ADAR1/2冲动剂处置THP1细胞,随后检测病毒传染后THP1的抗病毒基因表达程度。成果展现,EPI和NE以及ADAR1/2冲动剂能够显著按捺IFNB1以及CXCL10等抗病毒基因的表达。对信号通路中的关键卵白停止检测发现,固然TBK1的磷酸化水平没有明显差别,但是信号通路下流的MITA、IRF3以及STAT1的磷酸化程度显著降低。那表白肾上腺素/往甲肾上腺素通过按捺先天抗病毒路子中下流成分的激活,对先天抗病毒反响停止负性调剂。
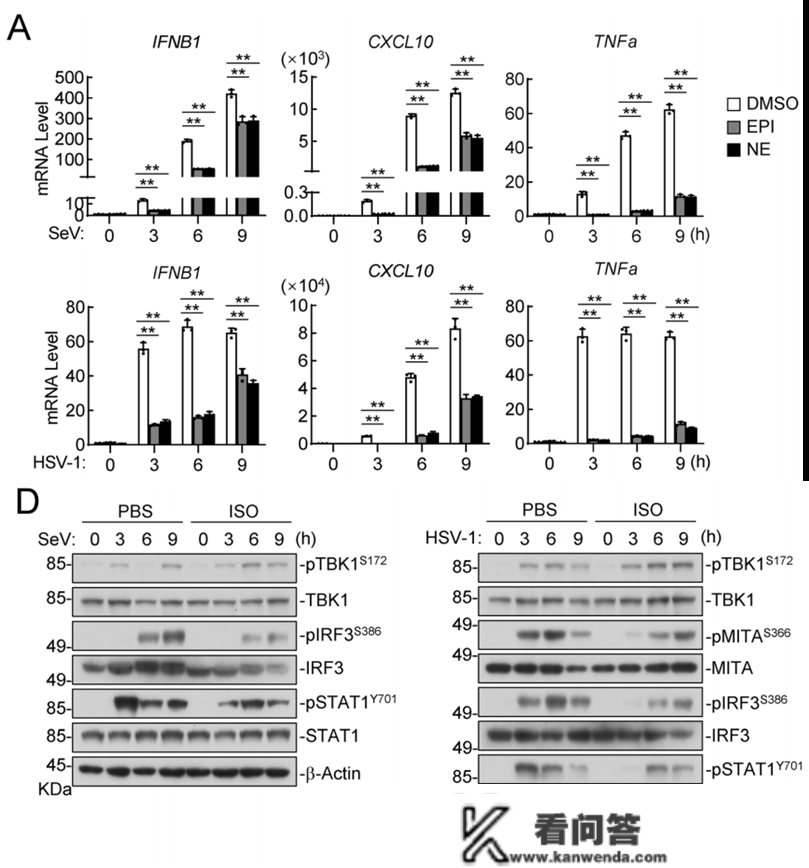
β-肾上腺素能按捺病毒诱导的先天免疫反响
研究团队探究在体内情况下肾上腺素信号能否会影响机体的抗病毒才能。尝试成果表白,腹腔打针ADAR1/2冲动剂ISO的病毒传染小鼠体内的病毒载量显著高于比照组,而且ISO处置显著增加了小鼠的灭亡率。那些数据表白,β-肾上腺素能按捺机体的抗病毒免疫力。
异丙肾上腺素按捺病毒诱导的体内先天免疫反响
ADAR1/2能够激活下流多种卵白激酶,包罗PKA、p38、AKT等,研究团队想晓得ADAR1/2激活后是通过哪个激酶按捺抗病毒免疫应答的,因而他们利用了差别的卵白激酶按捺剂处置,发现PKA按捺剂可以消弭ISO的免疫按捺效果。敲除巨噬细胞中的PKA后,ISO处置无法降低病毒传染引起的IFNB表达。那些数据表白,肾上腺素/往甲肾上腺素是通过 ADRB1/2-PKA 轴来按捺先本性抗病毒反响的。
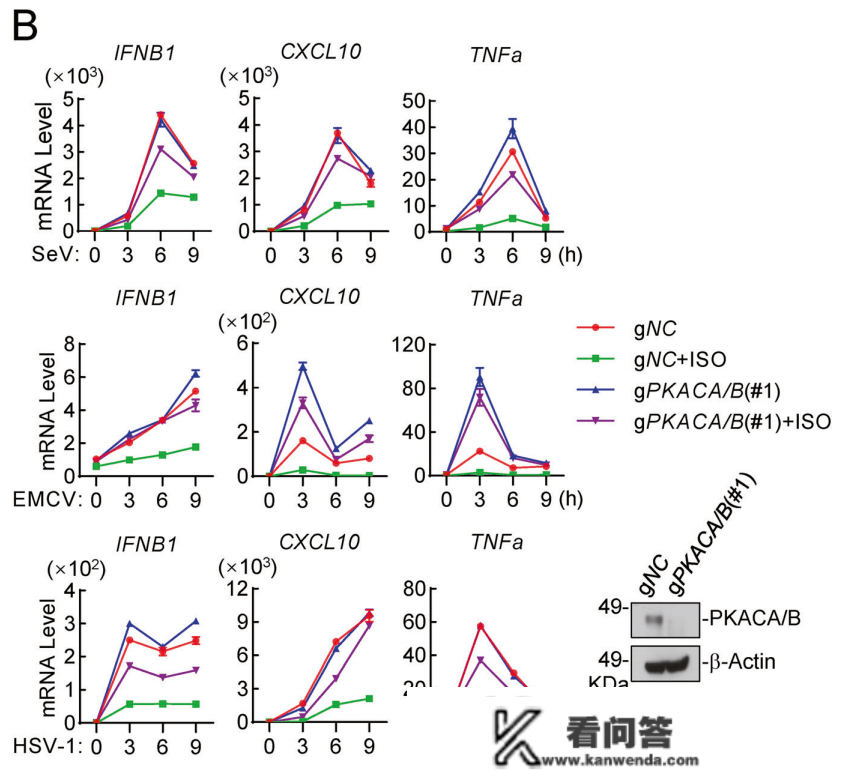
异丙肾上腺素通过 ADRB1/2-PKA 轴按捺先本性抗病毒反响
研究团队探究PKA是若何按捺抗病毒免疫反响的。先前有证据展现,PKA可以与VISA彼此感化,使VISA磷酸化并降解。研究人员证明了那一发现,而且进一步发现PKA能够使MITA磷酸化,并按捺其激活下流信号转导的才能。
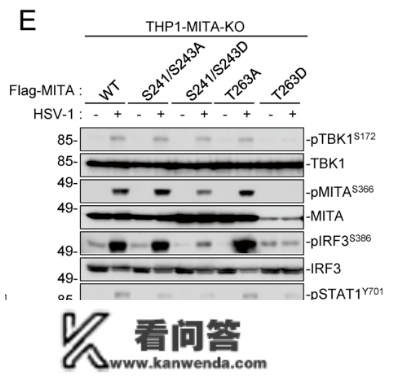
PKA引起MITA S241、S243和T263磷酸化削弱了它的激活
研究团队在小鼠模子中探究肾上腺素/往甲肾上腺素-ADRB1/2轴在体内先天抗病毒反响中的感化。成果展现,在病毒传染后,ISO处置组的小鼠保存率显著低于PBS比照组。那些数据表白,ISO-ADRB1/2轴特异性地按捺了先天抗病毒信号。
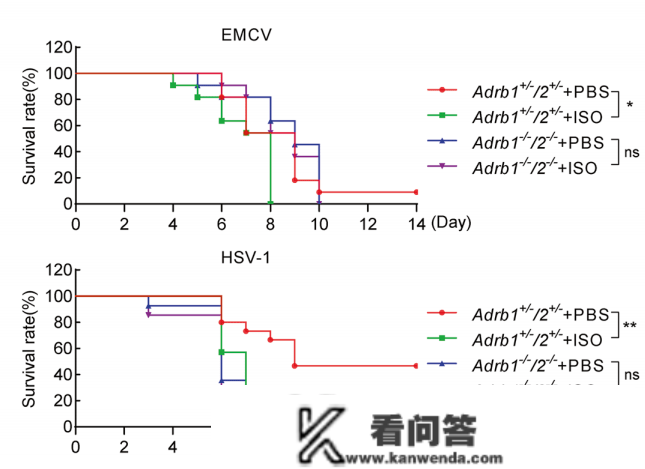
异丙肾上腺素-ADRB1/2轴负性调剂小鼠先天抗病毒反响
总的来说,那项研究表白,肾上腺素/往甲肾上腺素信号能够按捺机体的抗病毒固有免疫应答,其机造为增加PKA的表达,引起VISA的磷酸化降解以及MITA的磷酸化失活,从而按捺下流信号通路。
本期来源:CMI期刊
本期编纂:horizon
